1.题目:鞘氨醇-1-磷酸信号激活E-Syt1促进高密度脂蛋白衍生的胆固醇转运机制!
Sphingosine-1-phosphate signalling activates E-Syt1 to facilitate HDL-derived cholesterol transport
作者单位:
浙江大学
加拿大戴尔豪斯大学
加拿大多伦多大学
DOI: 10.1038/s41556-025-01665-2
期刊: NATURE CELL BIOLOGY
影响因子: 19.1
发表时间: 2025-05-28
中文摘要
源自高密度脂蛋白 (HDL) 的胆固醇迅速重新分布到类固醇生成细胞和胆汁生成细胞的细胞内隔室,但控制这一基本运输过程的分子机制仍然知之甚少。在这里,作者发现了一个信号级联,通过内质网 (ER) 和质膜 (PM) 之间的膜接触位点协调高密度脂蛋白衍生的胆固醇转运。作者发现 HDL 驻留鞘氨醇-1-磷酸 (S1P) 激活 S1P 受体 3 及其相关的 G 蛋白 αq,导致磷脂酶-C-β3 介导的磷脂酰肌醇 4,5-二磷酸水解和胞质钙升高。该钙信号触发扩展突触蛋白 1 快速募集到 ER-PM 膜接触位点。该途径的遗传或药理学破坏会损害高密度脂蛋白衍生胆固醇向细胞内区室的非囊泡转移。作者的研究结果揭示了HDL与细胞表面的结合如何通过S1P信号传导改变ER-PM膜接触位点动力学。这确保了高密度脂蛋白胆固醇的有效卸载和重新分配,以支持类固醇和胆汁酸的合成。
部分结果展示:
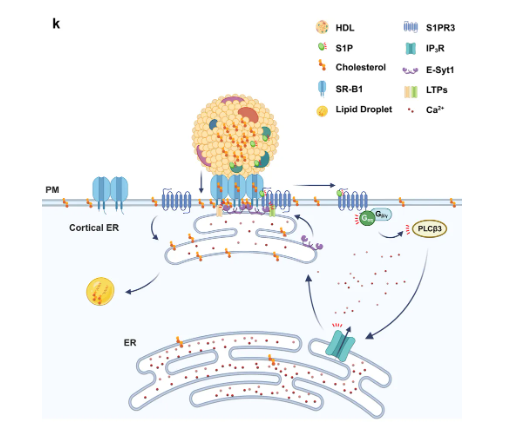
HDL诱导的导致胆固醇摄取的信号级联的示意模型(图源自Nature Cell Biology)
研究人员证明了S1P和S1PR3启动的信号转导级联反应增强了高密度脂蛋白衍生的胆固醇在肾上腺皮质细胞中从颗粒膜转移到内质网,最终转移到脂滴。从机制上来说,发现延伸突触结合蛋白1 (E-Syt1)是胞质Ca2+增加的关键传感器和快速反应者。E-Syt1的募集支持额外的ER–PM-MCS转移蛋白E-Syt2和Aster-B的募集,这有助于胆固醇的强劲运动。该发现揭示了高密度脂蛋白与细胞表面的结合是如何通过S1P信号改变内质网膜接触位点动力学的。这确保了高密度脂蛋白胆固醇的有效卸载和再分布,以支持类固醇和胆汁酸的合成。
中乔新舟人脐静脉内皮细胞永生化(货号:ZQ1099)参与了该项研究。
2.题目:用于器官规模投影的 3D 生物打印的生物墨水体系设计
Bioink design for organ-scale projection-based 3D bioprinting
作者单位:
浙江大学
DOI: 10.1038/s41596-025-01221-0
期刊: Nature Protocols
影响因子: 16.0
发表时间: 2025-07-30
中文摘要
基于投影的3D生物打印为制造具有复杂空间结构和生物活性的仿生组织提供了一种方法,为创建植入器官或类器官以测试药物反应提供了潜力。然而,器官规模的制造所需的延长打印时间是一个挑战。在这里,作者提供了使用生物墨水制造器官规模结构的分步说明,同时保持高生物活性。这种方法结合了 Ficoll 400 来减轻生物墨水在折射率和密度方面的异质性,而 4-(2-氨基乙基)苯磺酰氟和油封确保了生物墨水成分的稳定性,从而延长了打印时间。该程序还通过校准生物墨水的 pH 值实现高细胞活力打印。该协议适用于具有生物技术基本实验室技能和基础知识的用户,以制造器官规模的结构,以用于各种实验设计。该方法是通用的,成功打印细胞密度为每毫升 1000 万个海绵体结构(尺寸为 10 毫米× 10 毫米× 10 毫米)就证明了这一点。培养7 d后,细胞活力为82.5%,突出了在组织工程中的潜在适用性。所有生物墨水制备和打印步骤预计需要 5 小时,而打印结构的开发需要 7 天的连续培养。
部分结果展示:
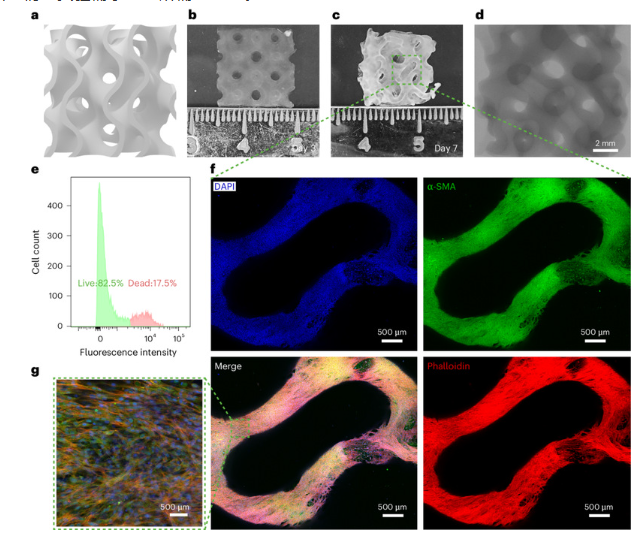
图7 器官尺度海绵体结构的生物打印
这项方案中,通过使用含有HUVEC、RS1和USMC细胞的生物墨水打印器官尺度阴茎海绵体结构,以展示这一体系的可行性,这些细胞代表了构成该组织的三种主要细胞类型。用户可以通过改变负载的细胞或培养条件,根据实验需求构建所需的结构。
中乔新舟人脐静脉内皮细胞永生化(货号:ZQ1099)参与了该项研究。
3. 题目:细胞间网状体促进肌浆网靶向治疗心肌缺血再灌注损伤
Intercellular NETwork-facilitated sarcoplasmic reticulum targeting for myocardial ischemia-reperfusion injury treatment
作者单位:
四川大学华西医院
DOI: 10.1126/sciadv.adr4333
期刊: Science Advances
影响因子: 12.5
发表时间: 2025-02-12
中文摘要
心肌缺血再灌注损伤(MIRI)常导致不可逆的心肌功能障碍,而现有疗法是暂时缓解疾病症状的姑息疗法。修复肌浆网 Ca2+-ATP酶(SERCA)可以逆转MIRI,然而,这需要精确的药物递送至肌浆网(SR)。为此,作者利用中性粒细胞的细胞间“网络”将载有 SERCA 激活剂的 SR 定位纳米颗粒 (LP-NP) 递送给受损心肌细胞,遵循分层靶向过程:(i) 趋化性中性粒细胞将 LP-NP 递送至缺血再灌注的心脏,实现组织水平靶向;(ii)中性粒细胞产生中性粒细胞细胞外陷阱(NET),将L-P-NP转运到受伤的心肌细胞,实现细胞水平靶向;(iii) L-P-NPs 护送治疗有效载荷到 SR,实现亚细胞靶向。研究表明,该平台深刻恢复了 SERCA 活性,增强了心脏功能,并改善了不良的心脏重塑。作者的研究提供了对直接恢复 SR 以有效治疗 MIRI 和其他肌肉疾病的见解。
部分结果展示:
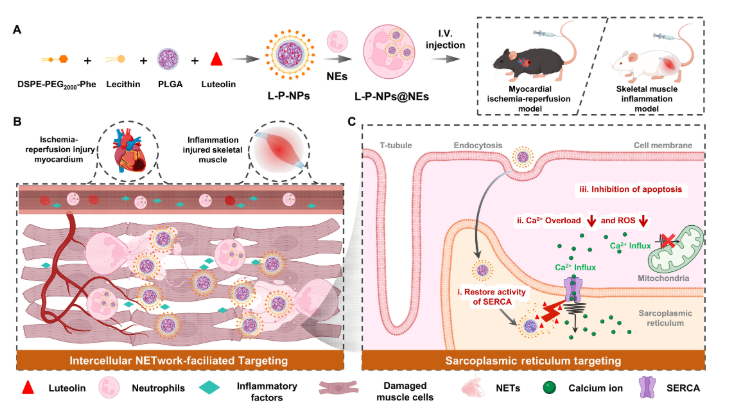
图1.用于心肌和骨骼肌损伤治疗的细胞间网络促进的 SR 靶向药物递送系统。
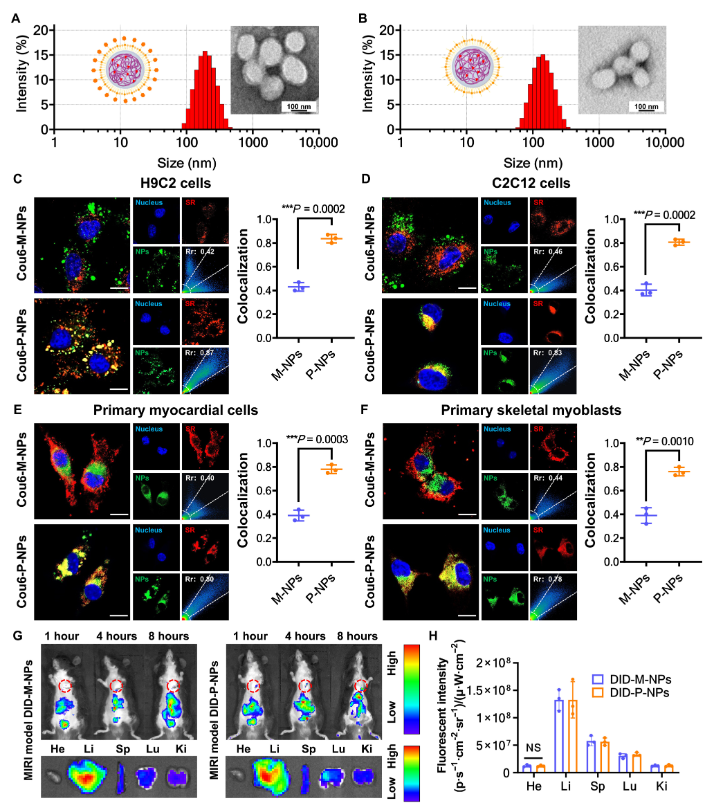
图2.LP-NP 以 SR 为目标。(C至F)H9C2细胞(C)、C2C12细胞(D)、原代心肌细胞(E)和原代骨骼成肌细胞(F)SR中纳米颗粒的代表性共聚焦激光扫描显微镜(CLSM)图像和共定位比。
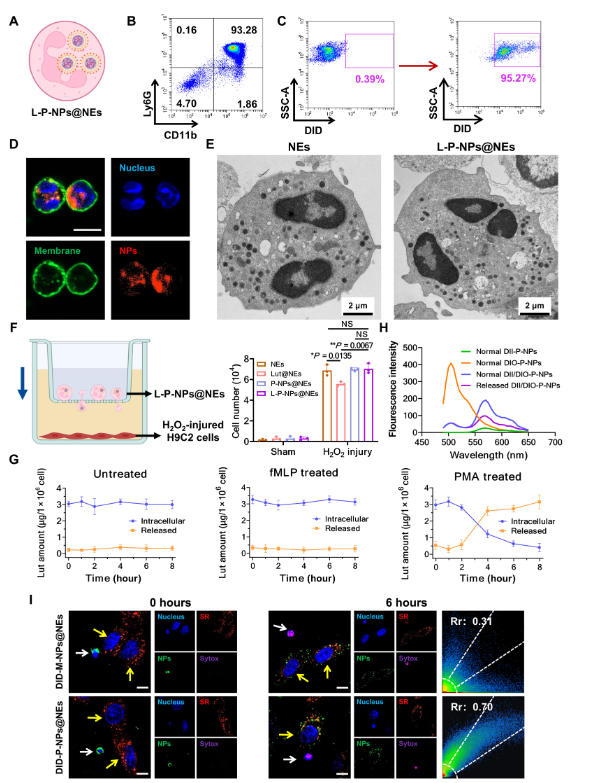
图3.细胞间网络介导使 L-P-NPs@NEs 能够靶向 SR。(I)在某些时间点(0和6小时)用PMA(100nM)处理的DID-P-NPs@NEs或DID-M-NPs@NEs孵育后H9C2细胞的代表性CLSM图像。蓝色:细胞核;绿色:载有 DID 的纳米颗粒;红色:SR;紫罗兰色:用 Sytox 绿色标记死 NE 的 DNA 片段。白色箭头表示NE,黄色箭头表示H9C2细胞。比例尺,20 μm。
该模型包括上腔中的人脐静脉内皮细胞(HUVEC)单层(模拟内皮)和H2O2-下腔室中受伤的H9C2心肌细胞,产生炎症趋化梯度(图S9A)。同时,上腔和下腔分别有HUVECs和正常H9C2心肌细胞的对照模型作为非梯度比较(图S9B)见原文。
通过体外血管壁模型评估 NE 的趋化性和跨内皮功能。研究者在顶部腔室接种一层HUVECs,在底部腔室培养H9C2细胞,用H
2O
2.接下来,L-P-NPs 和 L-P-NPs@NEs (1 × 10
6细胞)添加到转孔板的顶部腔室中。在37°C下孵育3小时后,作者通过HPLC评估底室(包括底液和H9C2细胞)中Lut的水平。
中乔新舟的大鼠H9C2细胞(货号:ZQ0102)、HUVEC细胞(货号:ZQ1099)和小鼠C2C12细胞(货号:ZQ0092)产品参与了该项研究。















 上海中乔新舟生物科技有限公司
上海中乔新舟生物科技有限公司